Advertisements
オクテット則
その考え方は、希ガスの電子配置が特に安定と考え、それ以外の原子は他の原子と電子をやり取りすることで希ガスの電子配置になろうとするために化学結合を形成するというものです。
水素やリチウムは最外殻に2個の電子をヘリウムの電子配置をとることで安定化し、それ以外の典型元素は最外殻に8個の電子を持つネオン以降の希ガスの電子配置をとることで安定化します。
しかしながら例外も存在し、超原子価化合物や遷移金属錯体ではこのオクテット則は説明に使えないことがあります。
希ガスの電子配置
ネオン(Ne)の電子配置を見てみましょう。ネオンの電子配置は[Ne]2s22p6でL殼に8個の電子が存在しオクテット則を満たしています。
※上付きの数字は電子の個数を示します。例えば2s2は「2s軌道に2個の電子が入っている」という意味です。最外殻の電子数のみを表していますが、それよりも内側の軌道にも電子は入っています。軌道については以前書いた記事「原子核の周りの電子」をご覧ください。
アルゴン(Ar)、クリプトン(Kr)、キセノン(Xe)の電子配置も見てみましょう。[Ar]3s23p6、[Kr]4s24p6、[Xe]5s25p6でやはり最外殻に8個の電子があります。
このように、希ガスは他の原子と電子をやり取りしなくても既にオクテット則を満たしているので単原子分子としてそれだけで存在できると考えられます。逆に電子をやり取りするとオクテット則から遠ざかるので反応性に乏しいと考えられます。
多原子分子
多原子分子の電子配置を見てみましょう。
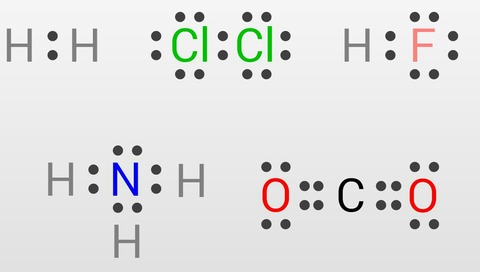
いくつかの化合物を、価電子を点(・)で表すルイス構造で示しました。どの原子の周りを見ても電子が8個、水素の周りには電子が2個存在しています。