Advertisements
何が酸化され何が還元されたのかを考える場面というのは多々あります。酸化数や酸化還元反応の考え方について今回は触れようと思います。
酸化数を決める際のルール
次のルールに則って酸化数を算出します。
1.酸化数はローマ数字で表記する。
2.単体(H2、O2、Na etc…)の原子の酸化数は0とする。
3.単原子からなるイオン(H+、Ca2+、I- etc…)はイオン価がそのまま酸化数になる。
H+:+I
Ca2+:+II
I-:-I
4.化合物中のHの酸化数は+I、Oの酸化数は-IIとする(例外については記事の後半に示す)。
5.電気的に中性である化合物(FeSO2、NaCl、H3PO4 etc…)において、それを構成する原子の酸化数の総和は0となる。また、多原子イオン(MnO4-、SO42- etc…)において、それを構成する原子の酸化数の総和は他原子イオン全体での電荷となる。
6.多原子分子、イオン化合物、多原子イオン等において、ある原子がそれよりも電気陰性度が小さい原子と結合している場合は電子を得ていると考える。また、ある原子がそれよりも電気陰性度が大きい原子と結合している場合は電子を奪われていると考える。また、結合の状態も考えに関与する(詳しくは例を見よ)。
ex.
電気陰性度:Cl > C > H
ジクロロメタン(CH2Cl2)では、CはHから電子を得ており、Hは電子を奪われていると考えます。また、ClはCから電子を得ており、Cは電子を奪われていると考えます。よって各原子の酸化数は、
C:-1 × 2 + +1 × 2 = 0
(計算内容)
-1はHから奪った分、2はHの個数、+1はClに奪われた分、2はClの個数
H:+I
Cl:-I
同様にメタン(CH4)での各原子の酸化数は、
C:-1 × 4 = -IV
H:+I
電気陰性度:O > C > H
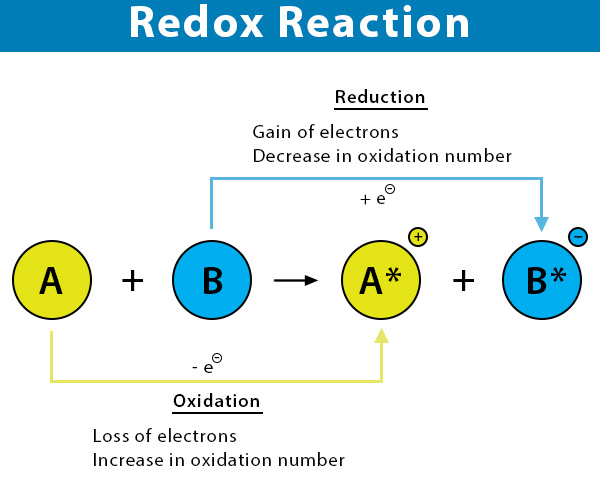
 ホルムアルデヒド(HCHO)では、CはHから電子を得ており、Hは電子を奪われていると考えます。また、OはCから電子を得ており、Cは電子を奪われていると考えます。この際、CとOは二重結合で結びついているので単結合の時の倍の電子をCは奪われていると考えます。よって各原子の酸化数は、
ホルムアルデヒド(HCHO)では、CはHから電子を得ており、Hは電子を奪われていると考えます。また、OはCから電子を得ており、Cは電子を奪われていると考えます。この際、CとOは二重結合で結びついているので単結合の時の倍の電子をCは奪われていると考えます。よって各原子の酸化数は、
C:-1 × 2 + +2 × 1 = 0
(計算内容)
-1はHから奪った分、2はHの個数、+2はOに奪われた分、1はOの個数
二重結合で結合しているOについてですが、単結合でOが2つ結合していると考えても同じになります。
H:+I
O:-II
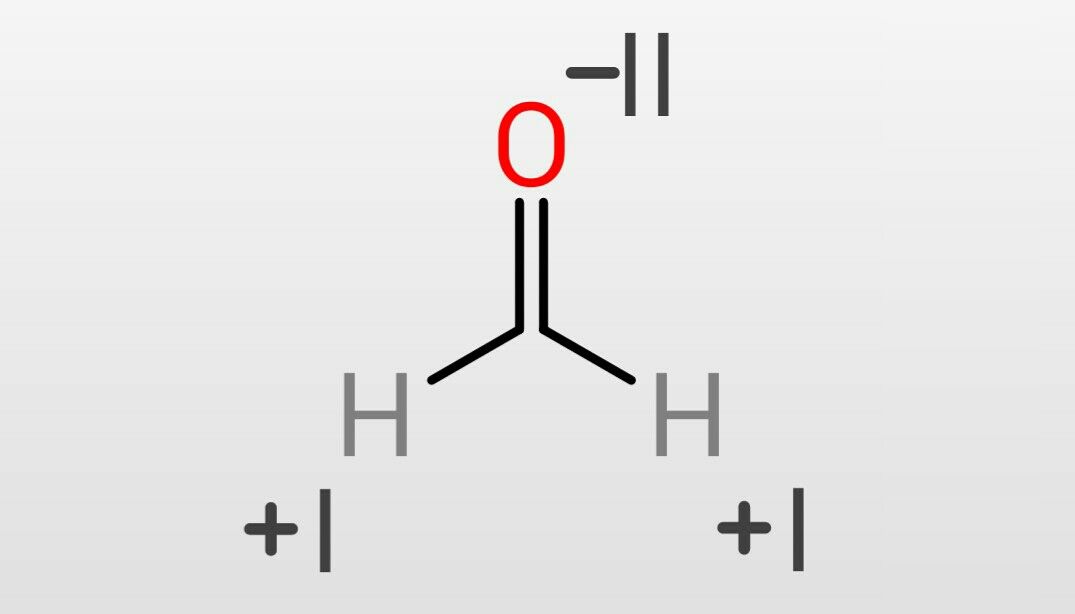
 過マンガン酸カリウム(KMnO4)では、
過マンガン酸カリウム(KMnO4)では、
K+:+I
MnO4-:-I
MnO4-は全体では-I、Oは-IIなのでMnの酸化数は、
-2 × 4 + x = -1
x = +VII
(計算内容)
-2はOの酸化数、4はOの個数、xはMnの酸化数、-1はMnO4-全体での電荷
ルール4の例外について
金属の水素化物(水素化リチウム(LiH)、水素化カルシウム(CaH2) etc…)においてはHの酸化数は-Iとなります。
その理由は、電気陰性度が金属MよりもHの方が大きいからです。
H > M
この場合はHがMから電子を奪う形になります。
Advertisements
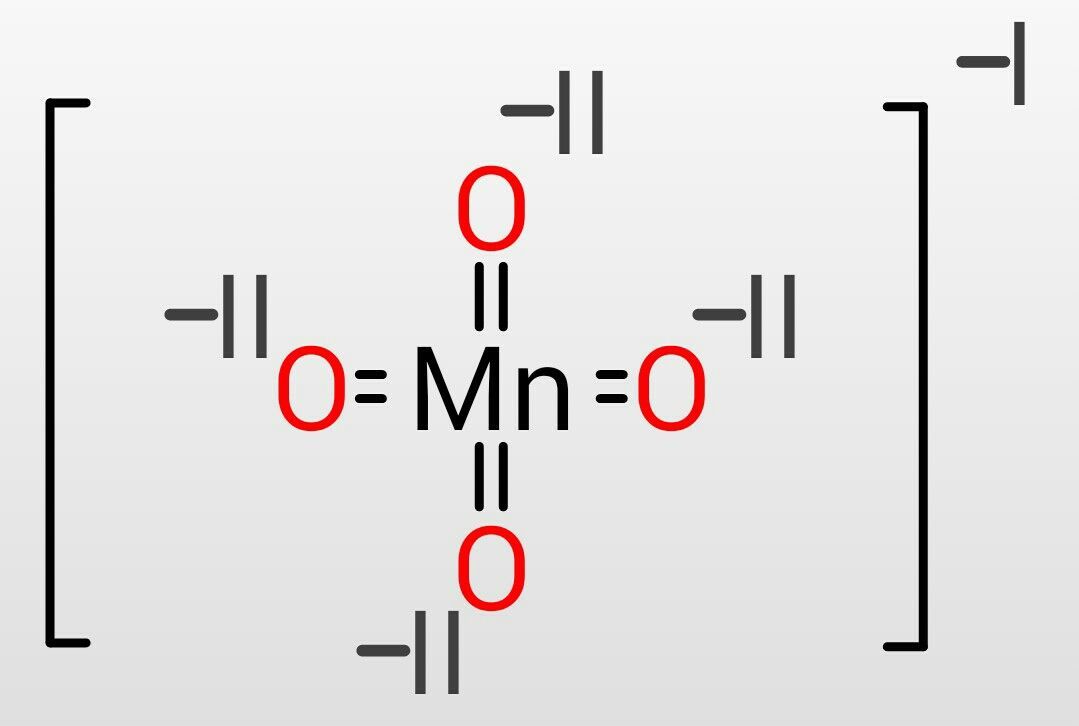
過酸化水素(HOOH)など、同じ元素が結合している化合物の場合の酸化数の計算は少し注意が必要です。
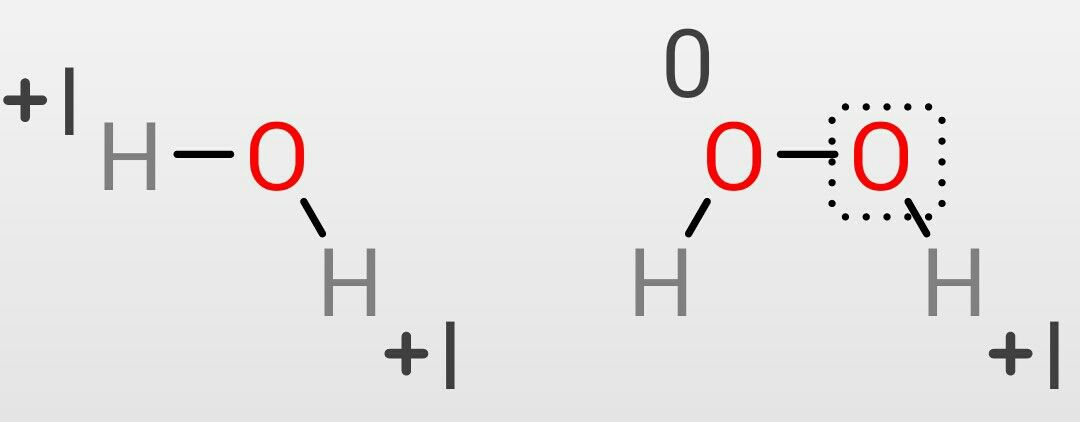 過酸化水素の各原子の酸化数は、
過酸化水素の各原子の酸化数は、
H:+I
O:-1 × 1 + 0 × 1 = -I
計算の内容は左から次の通りです。
-1はHから奪った分、1はHの個数、0は隣接するOとのやり取りが同じ原子のため無いという意味で、1はOの個数
となります。なので過酸化水素の場合はOの酸化数が異なるのです。水と過酸化水素は似ていますがこのような違いがあります。その他の過酸化物等でも同様で注意が必要となります。
酸化と還元を見極める
2KI + Cl2 → 2KCl + I2
ヨウ化カリウム(KI)と塩素分子(Cl2)が反応したとします。
反応物の各原子の酸化数は、
KI
K:+I
l:-I
Cl2
Cl:0
生成物の各原子の酸化数は、
KCl
K:+I
Cl:-I
I2
I:0
となります。ハロゲン間で電子のやり取りが起こっていると言えますね。IがClに電子を渡しているので、Iは酸化され、Clが還元されていると判断できます。
この場合、酸化剤はCl2、還元剤はKIとなります。
※
酸化剤:相手を酸化させる物質
還元剤:相手を還元させる物質
LiH + H2O → LiOH + H2
水素化リチウム(LiH)と水分子(H2O)が反応したとします。
反応物の各原子の酸化数は、
LiH
Li:+I
H:-I
H2O
H:+I
O:-II
生成物の各原子の酸化数は、
LiOH
Li:+I
O:-II
H:+I
H2
H:0
となります。LiHのH-がH2OのH+に電子を渡しているので、H-は酸化され、H+が還元されていると判断できます。
酸化還元を見極めるには、電子がどう動いたのか考える必要があります。


