Advertisements
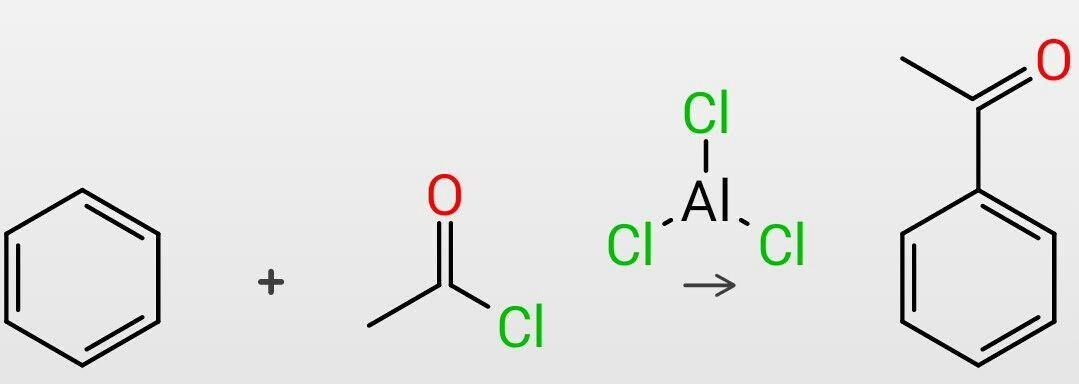
アシリニウムイオン(+COCH3)を生成してベンゼンと反応させることでベンゼンをアシル化することができます。その反応は上図のようにまとめられます。今回はこのアシル化について見ていきましょう。
アシリニウムイオンの生成
アシリニウムイオンは次のように生成します。

塩化アルミニウム(AlCl3)は空軌道を有する化合物なので電子対を受けとることが出来ます。これが塩素の非共有電子対を受けとることで塩素原子上にカチオンが生成しますがこのカチオンは非常に不安定なので速やかにC-Cl結合が切れてアシリニウムイオンが生成します。塩化アルミニウムはルイス酸として働いていることが分かります。
ベンゼンとアシリニウムイオンの反応
生成したアシリニウムイオンはベンゼンと次のように反応します。
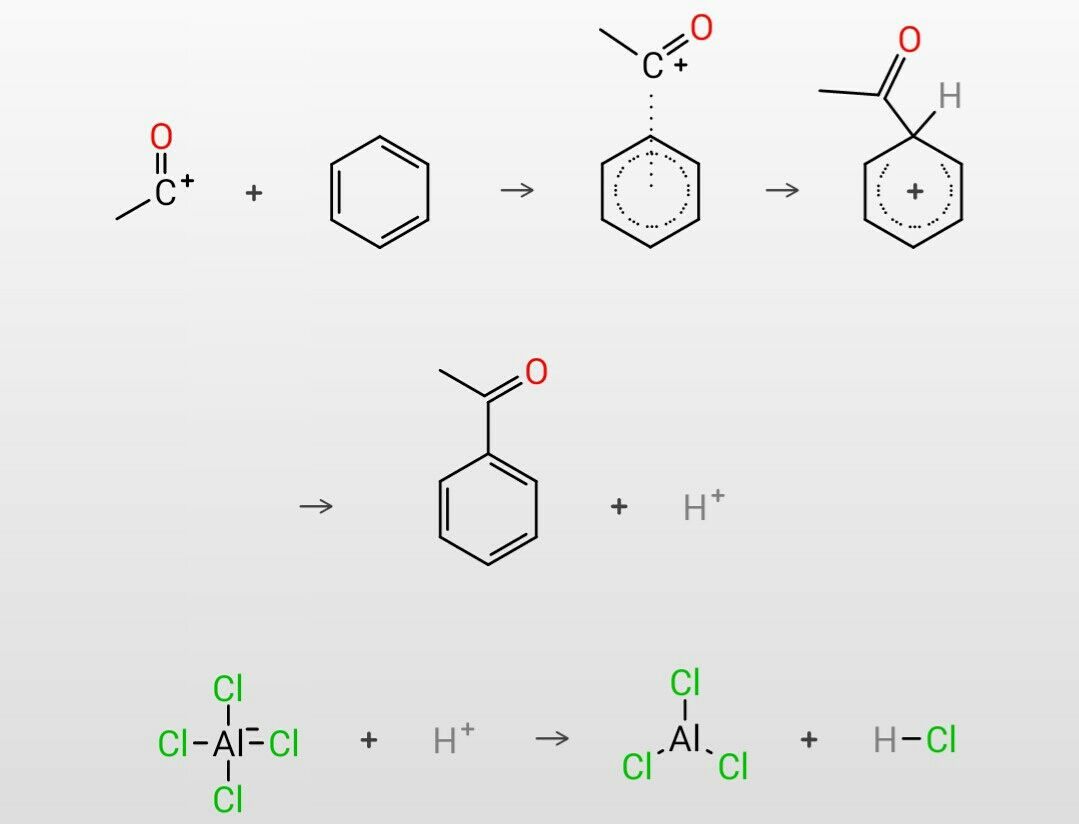
ベンゼンは二重結合が3つあり、電子密度が高いので電子を供与する働きをします。アシリニウムイオンに電子を供与することでベンゼンの上部にアシリニウムイオンが配位したπ-錯体を形成します。その後、アシリニウムイオンはベンゼンと同一平面上に移動してσ-錯体を形成し、プロトン(H+)が脱離することでアシル化が完了します。また、アシリニウムイオンの対イオンとして存在していたAlCl4-とその脱離したプロトンが反応し塩化水素(HCl)ともとの塩化アルミニウムが生成します。
この反応において必要な塩化アルミニウムの量は、アシリニウムイオンを生成する段階で塩化アルミニウムが消費される量とベンゼンがアシル化する段階で再生する塩化アルミニウムの量が等しいので触媒量でよいと思われるかも知れませんが実はそうではありません。
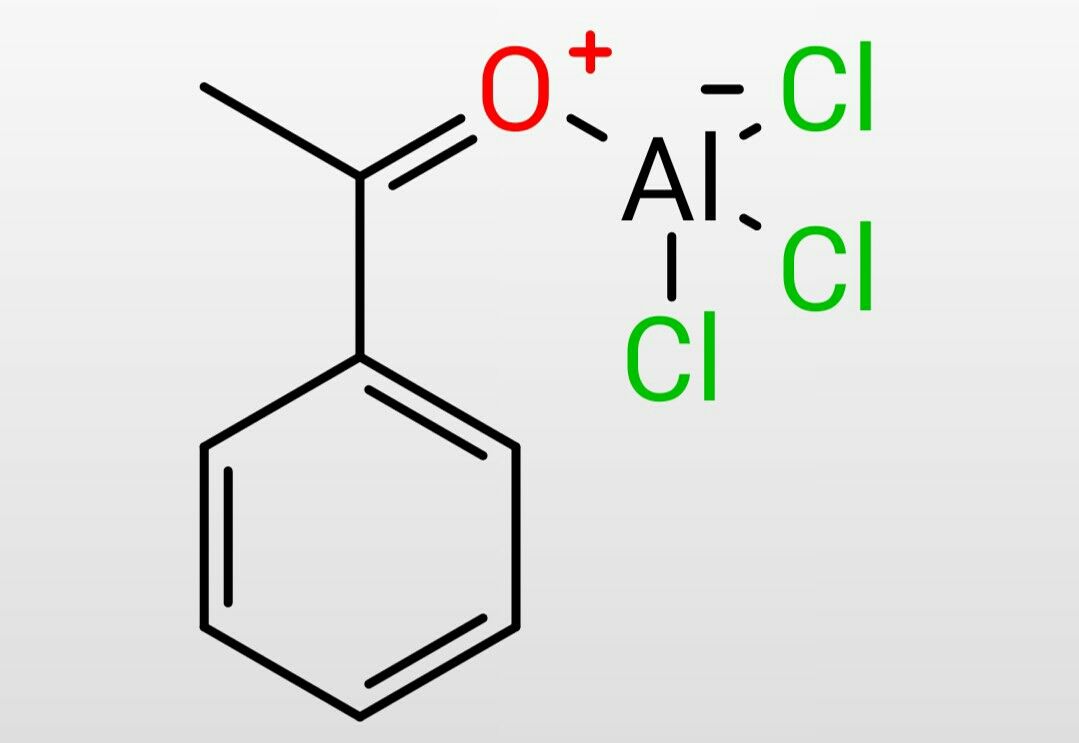
実際は生成物のカルボニルの酸素にも塩化アルミニウムは配位するためここでも塩化アルミニウムが消費されます。なのでこの生成物を1分子生成するにはアシリニウムイオンを生成する段階で1分子消費、ベンゼンをアシル化する段階で1分子再生、生成物に1分子配位するので結局1分子消費していることになります。触媒量では足りませんね。


