明らかな請求はありません
アミノ酸は、アミノ基 (-NH-2、アミノ) とカルボキシル基 (-COOH、カルボキシル) の両方を持つ化合物です。 この物質がイオン化して全電荷が0になるときのpH値を等電点といいます。 今日の短い記事では、この等電点の興味深い応用例をいくつか検討したいと思います。
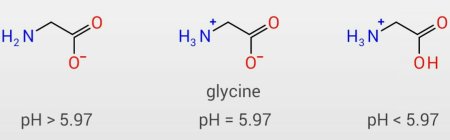
グリシンは最も単純なアミノ酸です。
研究により、グリシンの等電点は5.97であることが確認されています。 等電点では+と-があるので、電荷の合計は0になります。 この状態からpHが下がるとH + (プロトン)が増えるため、-COO-はH + を受け取ります。 逆に、pHが上昇するとOH - が増加するため、 - + NH3はHを失います。
等電点を適切に使用すると、2 つの物質を分離できます。
牛乳に酢酸を加えると白い物質が沈殿します。 この白い物質は牛乳に含まれるカゼインという物質で、等電点は約4.6です。
酢酸を添加すると牛乳の pH が低下し、等電点に達してカゼインが沈殿します。 降水の考えられる原因は次のとおりです。
物質がプラスに帯電している場合、プラスの電荷は互いに反発し、遠ざかります。 つまり、崩れやすいとも言えます。 マイナスの電荷を帯びている場合も同様です。
しかし、等電点に達すると見かけの電荷はなくなり、物質間の反発力はなくなります。 したがって、等電点では析出しやすいと言えます。
上記の議論から、適切な pH 値の下では、等電点に達すると、沈殿が容易になることがわかります。